Bài tập SGK Hóa Học 10 Bài 24: Sơ lược về hợp chất có oxi của clo.
-
Bài tập 1 trang 108 SGK Hóa học 10
Chọn câu đúng trong các câu sau:
A. Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit.
B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
C. Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit.
D. Clorua vôi không phải là muối.
-
Bài tập 2 trang 108 SGK Hóa học 10
Nêu tính chất hóa học chính và ứng dụng của nước Gia-ven, clorua vôi.
-
Bài tập 3 trang 108 SGK Hóa học 10
Trong phòng thí nghiệm có các hóa chất NaCl, MnO2, NaOH và H2SO4 đặc, ta có thể điều chế nước Gia – ven không? Viết các phương trình phản ứng.
-
Bài tập 4 trang 108 SGK Hóa học 10
Có những sơ đồ phản ứng hóa học sau:
a) Cl2 + H2O → HCl + HClO
b) CaOCl2 + HCl → CaCl2 + Cl2 + H2O
c) Cl2 + KOH → KCl + KClO3 + H2O
d) HCl + KClO3 → KCl + Cl2 + H2O
e) NaClO + CO2 + H2O → NaHCO3 + HClO
f) CaOCl2 → CaCl2 + O2
Cho biết những phản ứng nào là phản ứng oxi hóa – khử? Vai trò các chất tham gia phản ứng oxi hóa – khử. Hoàn thành phương trình hóa học của các phản ứng.
-
Bài tập 5 trang 108 SGK Hóa học 10
Trong phòng thí nghiệm có canxi oxit, nước, MnO2, axit H2SO4 70% (D = 1,61g/cm3) và NaCl. Hỏi cần phải dùng những chất gì và với lượng chất là bao nhiêu để điều chế 254 g clorua vôi?
-
Bài tập 24.1 trang 56 SBT Hóa học 10
Nước Gia-ven là hỗn hợp các chất nào sau đây ?
A. HCl, HClO, H2O
B. NaCl, NaClO, H2O
C. NaCl, NaClO3, H2O
D. NaCl, NaClO4, H2O
-
Bài tập 24.2 trang 57 SBT Hóa học 10
Tính chất sát trùng và tẩy màu của nước Gia-ven là do nguyên nhân nàc sau đây ?
A. Do chất NaClO phân huỷ ra oxi nguyên tử có tính oxi hoá mạnh.
B. Do chất NaClO phân huỷ ra Cl2 là chất oxi hoá mạnh.
C. Do trong chất NaClO, nguyên tử Cl có số oxi hoá là +1, thể hiện tính oxi hoá mạnh.
D. Do chất NaCl trong nước Gia-ven có tính tẩy màu và sát trùng.
-
Bài tập 24.3 trang 57 SBT Hóa học 10
Hãy chọn nửa sơ đồ phản ứng ở cột II để ghép với nửa sơ đồ phản ứng II cột I cho phù hợp.
Cột I Cột II a) Cl2 + H2O →
b) Cl2 + NaOH (dd) →
c) Cl2 + NaOH (dd) to→
d) KClO3 MnO2→
e) KClO3 to→
1) KCl + O2
2) NaCl + NaClO3 + H2O
3) NaCl + NaClO + H2O
4) HCl + HClO
5) KClO4 + KCl
6) HCl + H2O
7) K + Cl2 + O2
-
Bài tập 24.4 trang 57 SBT Hóa học 10
Số oxi hóa của clo trong HClO4 là
A. +3
B. +5
C. +7 D
. -1
-
Bài tập 24.5 trang 57 SBT Hóa học 10
Viết PTHH của các phản ứng trong sơ đồ biến đổi sau (ghi đầy đủ điều kiện phản ứng):
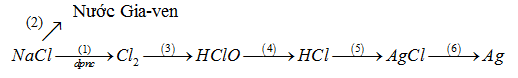
-
Bài tập 24.6 trang 57 SBT Hóa học 10
Viết PTHH của các phản ứng xảy ra trong quá trình sản xuất clorua vôi từ đá vôi và muối ăn.
-
Bài tập 24.7 trang 57 SBT Hóa học 10
Tại sao có thể dùng bình thép đựng khí clo khô mà không được dùng bình thép đựng khí clo ẩm ?






Thảo luận về Bài viết